 |
| Investigação com Biofertilizante, EL TENEBROSO (merda de vaca, rochas, sulfatos - sulfato ferroso - microrganismos locais e carvão micro-pulverizado), Sítio Solar Blanco/SP |
organização Oliver Naves Blanco
Engº Agrônomo
Engº Agrônomo
"Sideróforos é o sistema mais importante de proteção à saúde do solo, plantas, animais e oceanos. O Fe3+ é totalmente insolúvel. O Fe2+ é pouco solúvel, mas os saprófitos os transformam em moléculas orgânicas para evitar que os outros (patógenos) os utilizem e causem doenças. O uso de biofertilizantes com sideróforos (transportadores de Ferro) é o hit parade da agricultura". _ Sebastião Pinheiro em prosa..
O professor Sebastião Pinheiro me perguntou: 'que sabe el joven mancebo sobre sideróforos?' Sabia que não sabia quase nada, apenas que eram transportadores de Fe, citados em um de seus livros. Logo levei a informação para um grupo de amigos da FCAV no whatsapp.
O amigo 'Cuequita', José Luiz Pedreira Mouriño, professor da Universidade Federal de Santa Catarina, nos escreveu que os sideróforos são produzidos por bactéria pat para aprisionar o Fe e o utilizar na expressão de produção da virulência. Ácidos orgânicos ou biofertilizantes formam complexos quelantes e não deixam este Fe disponível aos patógenos. Além de serem utilizados, os ácidos orgânicos ou seus sais, para a formação de energia e tecidos. Ciclo de Krebs ou ciclo do Piruvato.. Cada ácido interfere com mais ou menos especificidade com cada patógeno; a exemplo, do produto comercial Kilol a base de ácido de cítrico natural, usado como antiparasitário e antibacteriano;e conclui que, a pressão dos ácidos orgânicos parece ser mais em relação as bactérias Gram -, aí a proporção entre bactérias Gram + e Gram - ficam mais equilibradas, assim os patógenos não expressam com maior rapidez a patogenecidade.
A maturação do solo e sua expressão de saúde e vida, ao ponto de ser o nosso segundo coração, tão somente passa pelo entendimento, em que nos rodeia a natureza de mistérios - húmus, humilde, humanos - como também pela insensatez do 'novo' vivente rural, de se proteger e buscar informações nas práticas (culturas comunitárias como referencial) de uma agriCultura regenerativa em que se considere como maior riqueza: os minerais/rochas, microrganismos.. + diversidade (vegetal/animal/...húmus, humanos) igualando localmente, a garantia de um quinta com dinâmica biológica, sendo a parte de um todo na Biosfera do planeta Azul. É mesmo de uma urgência e necessitamos estar atentos/as ao nível da ciência pós Normal, na defesa do empoderamento do conhecer, Saber e Fazer em totalizar a libertação ambiental no resgate da evolução sana de comunidades e culturas humanas, reunidas entorno da segurança alimentar, fora ou equilibrando-se dentro da sociedade extremamente industrializada, sem as garras gananciosas transacionais. Na América Latina, grandes organizações multinacionais são garimpeiras, e ladrões de Natureza.
Bem... recebemos alguns arquivos do professor Sebastião Pinheiro, de traduções científicas a revisões 'de el Matuto' e incluímos algumas mais pesquisas sobre o assunto seguinte...
Bem... recebemos alguns arquivos do professor Sebastião Pinheiro, de traduções científicas a revisões 'de el Matuto' e incluímos algumas mais pesquisas sobre o assunto seguinte...
Tradução - Microbial Siderophores: A mini review
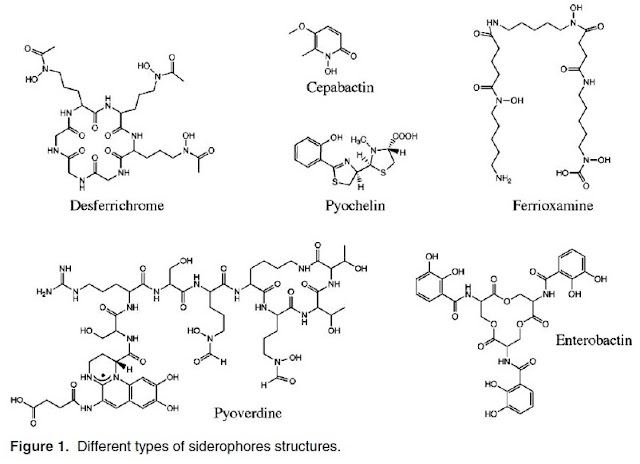
O ferro é um dos nutrientes essenciais para todos os microorganismos. Embora é abundante na natureza, não é fácil sua disponibilidade no estado preferido. Na presença de oxigênio e pH neutro sofre oxidação rápida a partir de Fe2+ para Fe3+ e finalmente forma o oxi-hidróxido férrico insolúvel que quase não está disponível para sua aquisição por micróbios (1-4). A disponibilidade do ferro é ao redor de 10-9 -10-18 M, mas os micróbio requerem um concentração de aproximadamente 1018 M para seu ótimo crescimento e levar a cabo uma fisiológico e metabólico processos (3,5). Tanto as bactérias (principalmente aeróbias) como os fungos, produzem um quelante de Fe em baixas condições, de limitação de ferro, conhecido como sideróforos (1, 2, 6). A origem da palavra siderophore é de uma palavra grega que significa "portador de ferro". Os sideróforos são compostos de baixo peso molecular de (400 a 1000 kDa) com alta afinidade pelo ferro (1, 2, 7 e 8). A gama, da constante associação de sideróforos para Fe3+ se encontra entre 1012 -1052 (9). Em linhas gerais, sideróforos podem ser classificados em três categorias segundo as quais é doadora de oxigênio para a coordenação do Fe3+: a) catecolatos (ou fenolatos), b) hidroxilatos (ou Carbooxilato) e c) os tipos mistos (10,11).
Exemplos de sideróforos que contem catecolato (o fenolato) são as enterobactinas (Streptomyces), vibriobactinas (Vibrio cholera) e pyochelin (Pseudomonas aeruginosa). O grupo hidroximato que contem sideróforos inclui alcaligin (Alcaligenes denitrificans), as fitoferrina (Staphylococcus spp.), enquanto que os exemplos dos tipos mistos são micobactina (Mycobacterium tuberculosis) e petrobactina (Bacillus anthrasis). Há dois sideróforos produzidos por fluorescentes Pseudomonads, pyoverdine [12-15] e pyochelins [16-18]. É pyoverdine que produzem a fluorescência verde amarelo em baixa condição deficiente de ferro. Pyoverdine com um grupo de cromóforos que é responsável da cor fluorescente da molécula [19-21]. Sideróforos são solúveis em água na natureza e geralmente são excretados no meio ambiente com algumas exceções, por exemplo, micobactina [22, 23]. Os fungos produzem sideróforos, que são principalmente hidroxymates [24, 25], embora poucos, são também conhecido por produzir carboxilato [25, 26] e Fenolato [27, 28]. A levedura Saccharomyces cerevisiae, pelo contrario, não produz sideróforos mas tem o sistema de captação de Fe-Sideróforo [29] e pode utilizar sideróforos, produzidos por outros microorganismos [30, 31]. Embora a deficiência é o fator chave que regula a sínteses de sideróforos, outros fatores externos como o pH, temperatura, a fonte de carbono e outros metais desempenham um papel tão importante quanto [32]. Hydroxymate siderophores tais como aerobactina são frequentes em pH baixo ou ácido, enquanto que sideróforos de catecolatos tais como yersiniabactina e salmochelin se produz em pH neutro ao alcalino em Escherichia coli cepa Nissel 1917 [33].
Necessidade de Ferro
O ferro é um dos mais importantes macronutrientes para o crescimento microbiano em ambiente diversos (1, 34-36). Nos microorganimos atua como um regulador global para muitos processos celulares, metabólicos e biosintéticos incluindo: i) sínteses de ADN, ii) sistema de transporte de elétrons, iii) formação de heme, iv) cofator para enzimas, v) transporte de oxigênio, vi) sínteses de ATP e vii) redução do nitrito no ciclo do nitrogênio. O ferro, no total, se requer para o crescimento ótimo e manter as atividades celulares de microorganismos (1, 4, 8, 38-40).
Biossínteses
A biossíntese de sideróforos em microorganimos é induzida pela deficiência intracelular de ferro, que, estas pequenas, moléculas de alta afinidade de ferro, são secretadas pela célula no meio ambiente para o ferro (39, 41, 42). Há duas vias envolvidas na sínteses de sideróforos: a) dependente de no-ribopéptideos sintéticos somáticos - NRPS - (43 - 45), b) de NRPS (47, 48). A síntese de ácidos aricapsilados sideróforos como pychelin (45) e pyoverdine (49-51) em P. aeruginosa, enterobactina em E. coli (43) Salmonella enterica, Klebsiella spp. (5) e micobactina em M. tuberculosis (52) são principalmente dependentes de NRPS. A sintetase de peptídeos no ribossômico são multicomplexos enzimáticos responsáveis pela sínteses de vários produtos peptídicos biologicamente importantes em modelo ARN (46, 53). Em geral, o NRPS consiste em três dominios: a) domínio de adenilação, b) peptidilcar - (PCP ou violação) e c) condensação, responsável pela montagem de uma ampliada rede de amino, carboxi e hidroxiácios em diversas combinações para produzir polipeptídeos com estruturas a variabilidade estrutural (54). O primeiro domínio do domínio de adenilação e, reconhece o aminoácido que é então ligado a um cofator neste domínio de violação e depois se incorpora na cadeia crescente de polipeptídeo através da formação da cadeia peptídica pelo domínio da rede. Finalmente, a cadeia polipeptídica se desfaz da sintetase por um evento de ciclização lyzed (quebra?) pela C terminal tioesterasa domínio (55). Sideróforos arilo encapsulados são sintetiados pelo NRPS. Os gene que codificam as enzimas responsaveis da Tes de ácidos arilo (ácido 2,3-dihidrobenzoico - DHB e salicilato) e NRPS esão regulados pelo repressor de Fur (38, 44). Em E. coli enterobactina biosinteses, o produto dos genes entB, entC e entA são responsaveis da sisnteses de DHB. Uma vez que se sintetiza o ácido arílico (DHB) junto com os aminoácidos (L-serina) conduz a montagem de enterobactina pelos NRPS. A enterobactina, o sistema NRPS conta de três enzimas EntE, EntB (terminal C) e EntF responsável da formação de enterobactina (56). Os sidefórofos hidroxilato e carboxilato, para exemplo petrobactina em B. anthasis (57), alcaligin em Bordetella pertussis (58, 59) estafiloferina A e estafiloloferrina B (60), em S. aureus são montados pelos NRPS mecanismo independete. A regulação do equilíbrio de ferro e sideróforo utilizados em gram-negativas e baixo conteúdo de GC Positivas (por exemplo, B. subtilis) se leva a cabo por proteínas de pele (61 - 68). Enquanto que no conteúdo de GC - Positivas como Strptomyces e Mycobacteria, o regulador da toxina difteria (DtxR) realiza a função (69). Ademais o repressor mundial fur, (pele?), há vários reguladores transcricionais que controlam a Biossíntese e utilização de sideróforos. Principalmente actúan como activadores mediante la detección de la combinación hierro-sideróforo complex, ya sea intracelular o extracelularmente, y puede se clasifican en varias clases [10], tales como: i) factores sigma alternativos, por ejemplo, el FecA - FecR – FecI Reguladora de proteínas en E. coli [70, 71], el FpvI / Pvd-FpvRFpvA en P. aeruginosa [72 - 74] ii) el 2 - compoNent sistema de transducción sensorial [75, 76] iii) AraC-tipo Reguladores, p. e. PchR en P. aeruginosa [76, 77], PdtC en P. stutzeri [78] MpeR es Nessieria patógena [79], YbtA en Yersinia pestis [80, 81], AlcR en Bordetella [82] iv) otros Factores transcripcionales, p. Reguladores de la familia LysR IrgB En V. cholerae [83] y FetR en V. anguillarum 775 (pJMI) [84]. El factor sigma de la función extracitoplásmica (ECF) y los sistemas AraC son a su vez regulados por Fur.
Mecanismo de señalización involucrado en pyoverdine Síntesis en Pseudomonas aeruginosa
Un ejemplo del sistema ECF sigma factor dependiente es encontrado en P. aeruginosa. En este sistema pyoverdine actúa como una molécula de señalización cuando primero se secreta bajo hierro-limitante. Cuando se excreta se la une a Fe3+ el complejo férrico-pyoverdine se une inicialmente al receptor de membrana externa FpvA [17, 73, 85 - 87]. FpvA entonces envía la señal a la parte de un antisigma factor FpvR presente en el periplasma [88, 89]. FpvR controla la actividad de la proteína extracitoplásmica PvdS [72, 90], que es un factor sigma e induce la expresión de los genes de síntesis de pyoverdine [91, 92] as así como la exotoxina A [93] y Prpl síntesis de genes [94]. FpvR actúa como un represor de la actividad de la segunda sigma factor FpvI que regula el gen fpvA que encodifica para el receptor de membrana externa FpvA. Tiene se ha observado que la producción de pyoverdine aumenta considerablemente la producción de FpvA que se el control de FpvI [73, 95, 96]. Por lo tanto, en este particular el factor antisigma FpvR controla dos sigma los factores PvdS y FpvI, que a su vez regulan dos actividades relacionadas con la producción de siderophores.
Mecanismo de exportação de sideróforos
O mecanismo envolvido na secreção ou exportação de Sideróforos fora da célula se leva a cabo mediante um transporte de proteínas ou uma bomba. Há três tipos principais de proteínas identificadas como implicadas neste processo: a superfamília principal facilitadora (MFS), a resistência, nodulação e a divisão celular (RND) superfamília e ABC Superfamília em E. coli, a exportação de enterobactina se realiza por uma proteína MFS chamada EntS codificada pelo gene ybda (97, 98). Recentemente, a secreção de bacillibactina em B. subtilis se encontrou que se levaram a cabo por um tipo similar MFS Transportador YmfE (99). Em P. aeruginosa, a secreção acha que a pyoverdina é levada a cabo pelo efluxo MexA-MexB-OprM, que é um típico RND superfamília transporte de proteínas (100, 101). Representantes do tipo ABC de transportadores implicado na exportação de sideróforo se encontram em S. aureus (102, 103), Mycobactetium tuberculosis (104) e M. smegmatis (105). Estudos recentes tem demonstrado que a férrica-pyoverdine complexo em P. aeruginosa se dissocia em periplasma, o ferro é liberdado pela redução e pyoverdine é então reciclado do periplasma ao meio externo mediante a bomba de efluxo PvdRT-OpmQ (106, 107). O ferrichrome siderophore por outro lado é transportado através da membrana externa através da FiuA e a FoxB receptoras (108).
Mecanismos de transporte do complexo ferro-sideróforo
Uma vez que o complexo sideróforo-Fe 3+ é acessível para captação celular, se internaliza em qualquer das formas gerais: a) o ferro se libera do complexo e entra na célula como um só íon (em algas filamentosas e fungos) ou b) todo o complexo de Fe 3+-sideróforo é internalizadas, por exemplo na maioria dos sistemas bacterianos (Figura 2). Uma vez dentro do periplasma, o Fe3+-sideróforo complexo, se transporta através da membrana interna ou seja através dos transportadores ABC - ferrichrome e Ferrienterobactina em E. coli - (109) ou permeasas - ferripioverdine em P. aeruginosa - (108).
A liberação de ferro do complexo Fe3+-sideróforo é também diferente entre micróbio e diferentes tipos de sideróforos. Por exemplo em ferrichome de E. coli e vías ferrienterobactin ferro se libera no ciplasma, enquanto que em P. aeruginosa ferricpyoverdine vía se libera no Periplasma (106, 107, 110). A absorção de Fe3+ -sideróforo complexo está mediado através da membrana externa proteínas receptoras de brana tales como FepA (para enterobactina), FhuA (para ferrichrome), e FecA (para citrato férrico) em E. coli (111, 113) e FpvA e fptA em P. aeruginosa (85, 114 - 116). a estrutura e o mecanismos de ação destes receptores tem sido recentemente estudados que uma mudança conformacional de um determinado destes receptores conduzem ao passo de subStrate (112, 117). A energia necessária para o transporte e subministrado pelo complexo de proteínas TonB (118, 119) que consta de outras proteínas da membrana interna ExbD e ExbB (120, 121). O papel de tonB-ExbD-ExbB complexo na transferência férrico-sideróforo, tem sido estudado em P. aeruginosa (118, 119, 122-124) e E. coli (95, 117, 121, 125). Recentemente, Chatfield et al. (126) informou um novo receptor de captação de ferro LbtU em Legionella Pneumophila independentemente de TonB. O tipo ABC de transporte proteico também estão envolvidos na entrega de ferro sideróforo no citosol. Em bactérias Gram negativas estas são extracitoplasmáticas obrigatória proteínas substrato localizadas no periplasma, enquanto que, em Gram positivas, esta estão presentes como lipoproteínas conectada a superfície externa da membrana celular (127 - 129). Na interação com o extracitoplásmico uma unidade de união, um substrato de transportador ABC, a unidade Fe-complexo sideróforo se canaliza através das membranas a energia necessária para estess processos se proporcionas pelas subunidades citoplasmáticas dos receptores ABC que experimentam uma dimensão ou mudança conformacional A a união ou hidrólises de NTP. Quatro subtipos de ABC Transportadores em sido descritos em bactérias Gram negativas que estão associadas com Fe-sideropore captação (10): a) o sistema fepBDGC de e. coli para Fe-enterobactina captação - o subtipo mais comum, com uma protéina extracitoplásmica para a união do substrato, das proteínas de membrana que atuam como canal transmembrana e uma subunidade citoplasmática; b) o sistema FhuDCB de E. coli (130) - aonde o componente transmembrana compreende somente uma cadeia polipeptídica única de FhuB; c) o sistema ViuP Vibrio cholera para Fe-vibriobactina captação (131) - que compreende de lipoproteínas para substrato uma característica típica da bactéria Gram positiva e d) em y. pestis ybtPQ sistema de Fe-yersiniabctin captação (132) - que consiste em segmentos transmembrana e uma dobra de união de nucleotídeos. Em leveduras e filamentos o complexo ferro-sideróforo é importadores de MFS (133).
Metabolismo do Ferro
Depois do transporte do complexo ferro-sideróforo na célula, o ferro se libera do complexo mediante vários mecanismos tais como o produto gênico i) fes (ferricenterobactina esterasa Fes) em E. coli ajuda na liberação hidrolítica de ferro dos sideróforos (134). Recentemente, informou-se que em cepas patogênicas de E. coli e Salmonela, cinco genes (iroB, iroC, iroD, iroE, iroN) codificados pelo locus iroA também foram responsáveis da liberação hidrolítica do ferro (135); i) a proteína ferro-enxofre, FhuF ajuda na mobilização do ferro de hidroxamato sideróforos pela atividade redutase (136) e iii) a flavina redutase geral em procariotas, reduz FMN, FAD e riboflavina utilizando NADH e NADPH e logo as flavinas redutase reduzidas, conduz na Redução dos complexos ferro-sideróforo da seguinte maneira: Fe (III) - sideróforos + NADP (H) Fe (II) - sideróforo + NAD (P)+ . O Fe solúvel (II) pode ser eliminado facilmente dos sideróforos e se utiliza diretamente em processos metabólicos e fisiológicos. Todos estes mecanismos implicam uma modificação química dos sideróforos. No entanto, recente achados demostram que o P. aeriginosa o ferro é liberdado do complexo férrico-pyoverdine simplesmente pela redução e a pyiverdine se libera reciclado em meio externo sem nenhuma modificação química (107, 138).
Regulação do Ferro nas bactérias
A regulação do ferro em bactérias gram-negativas e levada a cabo pelo regulador de absorção de ferro férrico (Fur) de protéinas (64, 65, 139, 140). Fur proteínas como se encontra também em muitas bactérias gram-positivas como B. subtilis (62). A proteína E. coli fur tem um peso molecular de 17 KDa e atua como um repressor transcricional. Regula negativamente a transcrição de genes de transporte de ferro mediante da união da região de união da pele presente água acima do gene de transporte de ferro conhecido como Fur box e se compõe de uma sequencia de repetição invertida de 19 pb. É ativado pelo ferro divalente (co-repressor) e logo reprime os gene de transporte de ferro de Downstream. A pele se une a condições deficientes de ferro, o metal se dissocia da proteína e os genes se expressão (51, 65). Em E. coli a proteína Fur controla em torno de 90 genes em nível transcricional (141). No mais, a proteína Fur ajuda na regulação de vários fatores determinantes de virulência em patógenos (139, 142). Para P. aeruginosa, a proteína Fur controla a expressão do fato sigma PvdS, que por sua vez regula a expressão da exotoxina A (93).
Significado ambiental dos sideróforos
Virulência
Diversos estudos (15, 81, 102 143-149) tem demostrado o papel dos sideróforos na mediação de patógenos (S. aureus, Listeria monocytogenes, Y. pestis, E. coli, K. pneumoniae, S. enterica, P. aeruginosa, B. subtilis) multiplicação e desenvolvimento de virulência. Em hospedeiros de mamíferos, o ferro extracelular está unido as proteínas da família da transferrina que são vitais na subministração do ferro as célula em todo o corpo. Esta estratégia, por sua vez, reduz a disponibilidade de ferro as bactérias patógenas, formando assim um componente importante da imunidade inata. Os sideróforos, devido a sua alta afinidade pelo ferro, competem com o hospedeiro de ferro vinculando proteínas de Fe3+ que é crítico para a sobrevivência de bactérias patógenas (8, 149). Por exemplo, a piridina em P. aeruginosa patógena pode sequestrar o ferro da lactoferrina do hospedeiro e a transferrina (150, 151). S. aureus utilizar seus sideróforos estafiloferrina A e estafiloferrina B para eliminar ferro da transferrina do sangue, para aumentar sua proliferação no hospedeiro (102). Junto com os sideróforos, o sistema de sinalização transmembrana implicado na captação do complexo de ironsideróforos é crucial para o desenvolvimento de fatores de virulência em bactérias como E. coli, B. cereus (152), P. aeruginosa (94, 153) e S. aureus (127). O sideróforo pyoverdine em P. aeruginosa além da extração do ferro do ambiente de benéfico se sabe que regula a produção de outros fatores de virulência como a exotoxina A e Prpl (94). Sideróforos também jogam um papel importante na formação de biofilms (154, 155). Por exemplo, nos pacientes com fibrose cística, a pioverdina é um dos fatores chave no desenvolvimento da biofilme (156).
Fitorremediação
Se tem utilizado bactérias produtoras de sideróforos para ajudar na fitoextração de metais pesados de ambientes contaminados. Os sideróforos produzidos pelas bactérias associadas com a rizosfera das plantas são de especial importância porque unem os íons de metais pesados e os pões disponíveis as raízes, melhorando assim a capacidade de fitoextração das plantas (157, 158). No mais, os sideróforos também proporcionam as plantas nutrientes (como o ferro), o que por sua vez contrapõe os efeitos nocivos do lento crescimento no metabolismo induzidos pelos metais pesados sobre a plantas (159). Por exemplo, os hidroxamatos sideróforos desferrioxamina B (DFOB), desferrioxamina E (DFOE) e coelichelin (Cch) produzidos por Streptomyces acidiscabies E13 e Straptomyces tendae F4 associados com o caupí (feijão-de-corda) (160) e o girassol (161), respectivamente, plantas em presença de Al, Cu, Mn, Ni, U (160) e Cd (161).
Os sideróforos reduzem a formação de radicais por união metálica na cercania das raízes, que por sua vez previne a degradação das auxinas microbianas, permitindo que as auxina potencialmente (162) ao fazer, desempenham sua função natural de promover o crescimento (160). Plantas de milho quando se inocula com P. aeruginosa, P. fluorescens e Ralstonia metallidurans que Pyoverdine produzido, pyochelin e alcaligelin E sideróforos, respectivamente, mostraram uma maior captação de Pb e Cr (163). Estes e vários outros estudos (157-164) tem destacado o potencial de inoculação de bactérias produtoras de sideróforos em plantas para sua capacidade de fitoextração em solos contaminados.
Fitopatologia
Há certas cepas de pseudomonas fluorescentes, conhecida como bactérias promotoras de crescimento vegetal (PGPB) que pode aumentar o crescimento de plantas e induzir a supressão de patógenos das plantas, quando inoculadas em sementes e outra partes subterrâneas (165-167). Um dos mecanismos subjacentes da supressão da enfermidade por PGRB é a produção de sideróforos como o Piochelin (165). Os sideróforos capturam o Fe ao redor (no local) das raízes e limita assim a quantidade de ferro requerida para o crescimento de patógenos como Fusarium oxusporum, Pythium ultimum e outros que causam murchamento e a enfermidade da prodridão das raízes nos cultivos (165, 168, 169). Alguns exemplos de sideróforos produtores de pseudomonas que tem sido proposto como agentes de biocontrole contra agentes de enfermidade do solo que inclui o P. fluorescente CHA0 (167), P. putida WCS (168), P. syringae pv. cepa da syringae 22d/93 (170). Estudos recentes tem demostrado que as inoculações de cepas de Pseudomonas como Bradyrhizobium e cepas de Ralstonia solani promovem o crescimento de leguminas e é completamente suprimida a enfermidade da podridão das raízes em condições experimentais (169).
Outros Metais
Os sideróforos produzidos por bactérias para a captação de ferro são também conhecidos para quelar outros metais a parte do ferro. Por exemplo, as desferroxaminas podem quelar níquel, cádmio, gálio, alumínio, vanádio e plutônio (162, 171 - 173), enquanto que a coelichelina pode quelar níquel e cádmio (162). Pyoverdine e pyochelin se informam para unir Ag+, Al3+, Cd2+, Co2+, Cr2+, Cu2+, Eu3+, Ga3+, Hg2+, Mn2+, Ni2+, Pb2+, Sn2+, Tb3+, Tl+ e Zn2+ (162, 174, 175). Os estudos tem demostrado que os metais, distintos do ferro também regulam a produção de sideróforos, dependente sobre a concentração de metais no crescimento médio (138, 176). Por exemplo, a produção de pyoverdine regulam-se sobre presença do Al3+, Cu2+, Cr2+, Ga3+, Mn2+ e Ni2+ em P. aeruginosa (175), azotochelin biossínteses foi estimulada por molibdênio em Azotobacter vinelandii (177), schizokinen e N-deoxyschizokinen a produção foi ativada em presença de concentrações de alumínio em B. megaterium (178). Desferrioxaminas B e E e Cch foram estimuladas por Cd e Ni incluso em presença de ferro férrico (162). Em P. aeruginosa, os complexos de piroddina-metal e unem ao receptor FpvA na superfície celular, inibindo assim a absorção de pioverdina-Fe3+ complexo. Encadeamento da Piruvino-metal com o receptor FpvA presumivelmente para ativar o sistema de sinalização FpvR/PvdS, que finalmente conduz a estimulação e produção da pioverdina (73, 90). Este sistema não requer a captação dos metais no citoplasma (138). Mas no caso da biossínteses de pyochelin, a piochelin-Fe depois da transferência através das células internas e externas da membranas interatuam com os reguladores AraC no citoplasma, o que requer a absorção de metal sideróforo complexo dentro do citoplasma (179). Dado que este mecanismo pode se perigoso para a célula, se os metais é tóxico, portanto, nenhum metal que não seja ativado na biossíntese do pyochelin. Metais como Fe3+, Cd2+, Cu2+, Eu3+, Ga3+, Mn2+, Ni2+ e Tb3+ quando adicionado ao ambiente de crescimento se sabe que reduzem a produção de pyochelin (176). Tal mecanismo passa-se a ter implicações na proteção das bactérias contra tóxicos no meio ambiente. Os sideróforos, por metais pesados fora da célula podem prevenir sua entrada dentro da célula por difusão através de Porins. Portanto, a capacidade de outros metais (tóxicos) que o Fe induz para a produção de sideróforos, desempenha papel importante na tolerância de metais pesados/tóxicos bacterianos (138, 179).
Biofilme
Um biofilme microbiano é uma comunidade complexa de microorganismos que crescem em uma superfície biótica ou abiótica em ambiente aquoso (180, 181). Pode ser composto de múltiplas espécies de organismos, incluindo bactérias gram-negativas junto com leveduras e protozoários (182). O desenvolvimento de um biofilme depende da disponibilidade de nutrientes e da superfície para a fixação (183, 184). O desenvolvimento de biofilme compreende quatro etapas seguintes: fixação de células planctônicas a cara, formação de microcolônias, maturação de microcolônias e finalmente o desprendimento do biofilme com estrutura madura. Microorganismos que constituem o biofilme possui comunidades extremamente complexas e fisiologia heterogênea e são muitos diferentes de seu padrões planctônicos; em contra partida são menos suscetíveis aos agentes antimicrobianos e portanto são difíceis de controlar (185, 186). Estudos tem demostrado que a concentração intracelular do ferro é uma peça importante no papel da formação do biofilme e desenvolvimento. Singh et al. (151) encontraram que a lactoferrina, o quelante do ferro no sangue de mamífero, maturação do biofilme de P. aeruginosa devido a um espasmo de motilidade exposta pela célula de P. aeruginosa em centralização que impede a formação de microcolônias para fixação a uma superfície de vidro. P. aeruginosa podem formar os biofilmes em forma de setas normais utilizando pyoverdine, pyochelin, citrato férrico ou ferrioxamina sideróforos (156). Bannin et al. (156) demonstra que os mutante de P. aeruginosa incapazes de biossíntese de pioverdine e piocheline, formou biofilme delgados em ausência de ferro. Assim, diferentes sistemas de absorção de ferro, dependendo dos diferentes ambientes pode ser crucial para o desenvolvimento de biofilmes maduros em P. aeruginosa Fur, parece regular o desenvolvimento de Biofilmes mediando a sinalização do ferro controlando o sistema de absorção de ferro e seus genes reguladores (156). Em M. smegmatis, a biossínte de exochelin é sistema essencial para o desenvolvimento de biofilmes, embora não para o crescimento planctônico (187).
Aplicações envolvendo sideróforos
Médica
Sideróforos mediado pela administração de fármacos (drogas): com o aumento da tendência de resistência aos antibióticos, tem convertido em um desenvolvimento de novas drogas e sistemas de fornecimento de tems. Desde que a captação de ferro é essencial para os patógenos, o sistema de aquisição de Fe-siderophore, as células tem explorado para fornecer drogas dentro da célula, um conceito que tem sido adotado de forma natural os compostos chamados sideromycins (danomyCins, albomycins, microsins). As sideromicinas são conjugadas portadoras de sideróforos como mediadoras para entrar nas células através do mecanismo de absorção de ferro. Esta estratégia é conhecida como "estratégia do Cavalo de Tróia" (38, 188, 189). Sintéticos análogos de sideróforos se utilizam para projetar conjugado sideróforo-antibióticos e estudos demostrado que a penetração de antibióticos (B-lactum e Sulfonamidas) através da membrana externa bacteriana, barreira através do sistema de captação de ferro mediado por sideróforo. Aumentado, quando se combina com sideróforos (189 - 192). Miller et al. (193) informou que a luta contra a malária, agente artemisinina, quando se conjuga com micobactina analítica, mostra atividade antimicrobiana em M. tuberculosis. Em 2004, alguns catecolato siderophore e B-lactum conjugados tem sido patenteados para seu uso em terapia (194). O uso de quelantes sintéticos para competir com sideróforos, o metal catiônico de gálio mostrou resultados contra as células planctônicas e biofilmes de P. aeruginosa por diminuição da captação de ferro pelo patógeno, o bloqueio de células receptoras de superfície para sideróforos (195) e aumentando a atividade antibiótica quando se conjuga com desferrioxamine (DFO) (156). A lactoferrina (151) e outros quelantes de ferro tais como Conalbumin (196, 197), férrico picolinato, acetohidroxamato férrico (198), 2,2 '- dipiridilo (2DP), ácido dietilentriaminpentacético (DTPA), EDTA, mesilato de deferoxamina (DM) e etilendiamina-N, N' - diacético (EDDA) (199) que competem com sideróforos nos orifícios para unir Fe3+, e se tem demostrado reduzir crescimento e formação de biofilme por P. aeruginosa. Recentemente, Moreau-Marquis et al. (200) demostraram que desferroxamina e desferasirox tiveram exito em agosto. A capacidade da tobramicina antibiótica para reduzir Biopelículas bacterianas causadas por antibiótico resistente a P. aeruginosa em células de fibroses quística.
Inibição das vias de biossínteses de sideróforos: outra forma de controlar a multiplicação de patógenos é a utilização de compostos químicos que bloqueiam sideróforos mediante a inibição das enzimas envolvidas no processo. A maioria dos estudos, os NRPS que estão implicados na sínteses de todos os aril cobertos e requer salicilato (SAL) o DBH (2,3 - dihidroxibenzoato) como seus substratos iniciais.
O domínio de ácido arílico A de NPRS cataliza a etapa de formação de sideróforos mediante a ativação do (SAL o DHB) via adenilação. Portanto, se tem projetado alguns inibidores que inibem a atividade catalítica do domínio de ácido arílico A, evitando o crescimento de patógenos em condições de ferro limitado (10). Exemplos de tais inibidores incluem p-aminosalisilato (PAS) em M. smegmatis e M. bovis (201), aril-ácido A domínio análogo SAL-AMS (salicil sulfamoil adenosina). Em M. tuberculosis e Y. pestis (202). Recentemente, uma nova técnica de deslocamento de polarização de fluorescência, tem sido utilizadas para criar novos inibidores de ácido aril adenilando enzimas que estavam implicadas na biossínteses de siderophore (203). Outro enfoque consiste em grupos de genes implicados na biossíntese de sideróforos que tem sugerido em M. tubercuolsis (104) e S. aureus (127)
Tipagem Bacteriana
Nas pseudomonas fluorescentes, sideróforo (pyoverdine) pode utilizar-se como um marcador taxonômico para diferenciar entre cepas extremamente relacionadas (204-206). Técnicas tais como espectrometria de massas (207) e isoeletroforesis (2) se tem utilizado como métodos eficazes de tipagem de sideróforos (208). No mais, a investigação e o desenvolvimento estão garantindo desenvolver uma base de dados e uma plataforma dedicadas a utilizar esta técnica.
Siderófosos e 'incultiváveis'
As técnicas tradicionais de cultivo mediante técnicas bacteriológica do meio de comunicação subestimam a distribuição abundante de população bacteriana total de diferetens amostras ambientais (209). Dados moleculares baseados em 16SrRNA gen estudo revelou que 99% da bacteria não cultivadas de qualquer meio ambiente em tempo dado. Recentement, um interessante estudo realizado por D'onofrio et al. (210) informaram que os sideróforos produzem as bacterias cultivadas desempenhando um papel importante no crescimento de bacterias incultas em meio sintéticos (Figura 3). Portanto, várias bacterias incultas poderiam ser recuperadas em meios sintéticos modificados com sideróforos, o qie pode conduzir ao descobrimento de microorganismos.
Conclusão
Os sideróforos são moléculas pequenas com grande potencial lógico. Com o advento de novos métodos e tecnologias de investigação e desenvolvimento que necessita se para aproveitar o aspecto benéfico destas moléculas no campo tanto da medicina como da microbiologia ambiental.
Pesquisar também:
- Biocontrol Mechanisms of siderophores against Bacterial Plant Pathogens
- SIDERÓFOROS: "UMA RESPOSTA DOS MICROORGANISMOS"
E aí, vamos elaborar Biofertilizantes (BIOPLASMA) na roça, na cidade (hortas comunitárias) nas comunidades rurais, nas universidades..?
'O resgate da memória e conhecimento sedimentam a identidade cultural, única forma de poder para dar autossustentabilidade à agriCultura'.
abraços
Feliz Natal
Oliver Blanco
A biossíntese de sideróforos em microorganimos é induzida pela deficiência intracelular de ferro, que, estas pequenas, moléculas de alta afinidade de ferro, são secretadas pela célula no meio ambiente para o ferro (39, 41, 42). Há duas vias envolvidas na sínteses de sideróforos: a) dependente de no-ribopéptideos sintéticos somáticos - NRPS - (43 - 45), b) de NRPS (47, 48). A síntese de ácidos aricapsilados sideróforos como pychelin (45) e pyoverdine (49-51) em P. aeruginosa, enterobactina em E. coli (43) Salmonella enterica, Klebsiella spp. (5) e micobactina em M. tuberculosis (52) são principalmente dependentes de NRPS. A sintetase de peptídeos no ribossômico são multicomplexos enzimáticos responsáveis pela sínteses de vários produtos peptídicos biologicamente importantes em modelo ARN (46, 53). Em geral, o NRPS consiste em três dominios: a) domínio de adenilação, b) peptidilcar - (PCP ou violação) e c) condensação, responsável pela montagem de uma ampliada rede de amino, carboxi e hidroxiácios em diversas combinações para produzir polipeptídeos com estruturas a variabilidade estrutural (54). O primeiro domínio do domínio de adenilação e, reconhece o aminoácido que é então ligado a um cofator neste domínio de violação e depois se incorpora na cadeia crescente de polipeptídeo através da formação da cadeia peptídica pelo domínio da rede. Finalmente, a cadeia polipeptídica se desfaz da sintetase por um evento de ciclização lyzed (quebra?) pela C terminal tioesterasa domínio (55). Sideróforos arilo encapsulados são sintetiados pelo NRPS. Os gene que codificam as enzimas responsaveis da Tes de ácidos arilo (ácido 2,3-dihidrobenzoico - DHB e salicilato) e NRPS esão regulados pelo repressor de Fur (38, 44). Em E. coli enterobactina biosinteses, o produto dos genes entB, entC e entA são responsaveis da sisnteses de DHB. Uma vez que se sintetiza o ácido arílico (DHB) junto com os aminoácidos (L-serina) conduz a montagem de enterobactina pelos NRPS. A enterobactina, o sistema NRPS conta de três enzimas EntE, EntB (terminal C) e EntF responsável da formação de enterobactina (56). Os sidefórofos hidroxilato e carboxilato, para exemplo petrobactina em B. anthasis (57), alcaligin em Bordetella pertussis (58, 59) estafiloferina A e estafiloloferrina B (60), em S. aureus são montados pelos NRPS mecanismo independete. A regulação do equilíbrio de ferro e sideróforo utilizados em gram-negativas e baixo conteúdo de GC Positivas (por exemplo, B. subtilis) se leva a cabo por proteínas de pele (61 - 68). Enquanto que no conteúdo de GC - Positivas como Strptomyces e Mycobacteria, o regulador da toxina difteria (DtxR) realiza a função (69). Ademais o repressor mundial fur, (pele?), há vários reguladores transcricionais que controlam a Biossíntese e utilização de sideróforos. Principalmente actúan como activadores mediante la detección de la combinación hierro-sideróforo complex, ya sea intracelular o extracelularmente, y puede se clasifican en varias clases [10], tales como: i) factores sigma alternativos, por ejemplo, el FecA - FecR – FecI Reguladora de proteínas en E. coli [70, 71], el FpvI / Pvd-FpvRFpvA en P. aeruginosa [72 - 74] ii) el 2 - compoNent sistema de transducción sensorial [75, 76] iii) AraC-tipo Reguladores, p. e. PchR en P. aeruginosa [76, 77], PdtC en P. stutzeri [78] MpeR es Nessieria patógena [79], YbtA en Yersinia pestis [80, 81], AlcR en Bordetella [82] iv) otros Factores transcripcionales, p. Reguladores de la familia LysR IrgB En V. cholerae [83] y FetR en V. anguillarum 775 (pJMI) [84]. El factor sigma de la función extracitoplásmica (ECF) y los sistemas AraC son a su vez regulados por Fur.
Mecanismo de señalización involucrado en pyoverdine Síntesis en Pseudomonas aeruginosa
Un ejemplo del sistema ECF sigma factor dependiente es encontrado en P. aeruginosa. En este sistema pyoverdine actúa como una molécula de señalización cuando primero se secreta bajo hierro-limitante. Cuando se excreta se la une a Fe3+ el complejo férrico-pyoverdine se une inicialmente al receptor de membrana externa FpvA [17, 73, 85 - 87]. FpvA entonces envía la señal a la parte de un antisigma factor FpvR presente en el periplasma [88, 89]. FpvR controla la actividad de la proteína extracitoplásmica PvdS [72, 90], que es un factor sigma e induce la expresión de los genes de síntesis de pyoverdine [91, 92] as así como la exotoxina A [93] y Prpl síntesis de genes [94]. FpvR actúa como un represor de la actividad de la segunda sigma factor FpvI que regula el gen fpvA que encodifica para el receptor de membrana externa FpvA. Tiene se ha observado que la producción de pyoverdine aumenta considerablemente la producción de FpvA que se el control de FpvI [73, 95, 96]. Por lo tanto, en este particular el factor antisigma FpvR controla dos sigma los factores PvdS y FpvI, que a su vez regulan dos actividades relacionadas con la producción de siderophores.
Mecanismo de exportação de sideróforos
O mecanismo envolvido na secreção ou exportação de Sideróforos fora da célula se leva a cabo mediante um transporte de proteínas ou uma bomba. Há três tipos principais de proteínas identificadas como implicadas neste processo: a superfamília principal facilitadora (MFS), a resistência, nodulação e a divisão celular (RND) superfamília e ABC Superfamília em E. coli, a exportação de enterobactina se realiza por uma proteína MFS chamada EntS codificada pelo gene ybda (97, 98). Recentemente, a secreção de bacillibactina em B. subtilis se encontrou que se levaram a cabo por um tipo similar MFS Transportador YmfE (99). Em P. aeruginosa, a secreção acha que a pyoverdina é levada a cabo pelo efluxo MexA-MexB-OprM, que é um típico RND superfamília transporte de proteínas (100, 101). Representantes do tipo ABC de transportadores implicado na exportação de sideróforo se encontram em S. aureus (102, 103), Mycobactetium tuberculosis (104) e M. smegmatis (105). Estudos recentes tem demonstrado que a férrica-pyoverdine complexo em P. aeruginosa se dissocia em periplasma, o ferro é liberdado pela redução e pyoverdine é então reciclado do periplasma ao meio externo mediante a bomba de efluxo PvdRT-OpmQ (106, 107). O ferrichrome siderophore por outro lado é transportado através da membrana externa através da FiuA e a FoxB receptoras (108).
Mecanismos de transporte do complexo ferro-sideróforo
Uma vez que o complexo sideróforo-Fe 3+ é acessível para captação celular, se internaliza em qualquer das formas gerais: a) o ferro se libera do complexo e entra na célula como um só íon (em algas filamentosas e fungos) ou b) todo o complexo de Fe 3+-sideróforo é internalizadas, por exemplo na maioria dos sistemas bacterianos (Figura 2). Uma vez dentro do periplasma, o Fe3+-sideróforo complexo, se transporta através da membrana interna ou seja através dos transportadores ABC - ferrichrome e Ferrienterobactina em E. coli - (109) ou permeasas - ferripioverdine em P. aeruginosa - (108).
A liberação de ferro do complexo Fe3+-sideróforo é também diferente entre micróbio e diferentes tipos de sideróforos. Por exemplo em ferrichome de E. coli e vías ferrienterobactin ferro se libera no ciplasma, enquanto que em P. aeruginosa ferricpyoverdine vía se libera no Periplasma (106, 107, 110). A absorção de Fe3+ -sideróforo complexo está mediado através da membrana externa proteínas receptoras de brana tales como FepA (para enterobactina), FhuA (para ferrichrome), e FecA (para citrato férrico) em E. coli (111, 113) e FpvA e fptA em P. aeruginosa (85, 114 - 116). a estrutura e o mecanismos de ação destes receptores tem sido recentemente estudados que uma mudança conformacional de um determinado destes receptores conduzem ao passo de subStrate (112, 117). A energia necessária para o transporte e subministrado pelo complexo de proteínas TonB (118, 119) que consta de outras proteínas da membrana interna ExbD e ExbB (120, 121). O papel de tonB-ExbD-ExbB complexo na transferência férrico-sideróforo, tem sido estudado em P. aeruginosa (118, 119, 122-124) e E. coli (95, 117, 121, 125). Recentemente, Chatfield et al. (126) informou um novo receptor de captação de ferro LbtU em Legionella Pneumophila independentemente de TonB. O tipo ABC de transporte proteico também estão envolvidos na entrega de ferro sideróforo no citosol. Em bactérias Gram negativas estas são extracitoplasmáticas obrigatória proteínas substrato localizadas no periplasma, enquanto que, em Gram positivas, esta estão presentes como lipoproteínas conectada a superfície externa da membrana celular (127 - 129). Na interação com o extracitoplásmico uma unidade de união, um substrato de transportador ABC, a unidade Fe-complexo sideróforo se canaliza através das membranas a energia necessária para estess processos se proporcionas pelas subunidades citoplasmáticas dos receptores ABC que experimentam uma dimensão ou mudança conformacional A a união ou hidrólises de NTP. Quatro subtipos de ABC Transportadores em sido descritos em bactérias Gram negativas que estão associadas com Fe-sideropore captação (10): a) o sistema fepBDGC de e. coli para Fe-enterobactina captação - o subtipo mais comum, com uma protéina extracitoplásmica para a união do substrato, das proteínas de membrana que atuam como canal transmembrana e uma subunidade citoplasmática; b) o sistema FhuDCB de E. coli (130) - aonde o componente transmembrana compreende somente uma cadeia polipeptídica única de FhuB; c) o sistema ViuP Vibrio cholera para Fe-vibriobactina captação (131) - que compreende de lipoproteínas para substrato uma característica típica da bactéria Gram positiva e d) em y. pestis ybtPQ sistema de Fe-yersiniabctin captação (132) - que consiste em segmentos transmembrana e uma dobra de união de nucleotídeos. Em leveduras e filamentos o complexo ferro-sideróforo é importadores de MFS (133).
Metabolismo do Ferro
Depois do transporte do complexo ferro-sideróforo na célula, o ferro se libera do complexo mediante vários mecanismos tais como o produto gênico i) fes (ferricenterobactina esterasa Fes) em E. coli ajuda na liberação hidrolítica de ferro dos sideróforos (134). Recentemente, informou-se que em cepas patogênicas de E. coli e Salmonela, cinco genes (iroB, iroC, iroD, iroE, iroN) codificados pelo locus iroA também foram responsáveis da liberação hidrolítica do ferro (135); i) a proteína ferro-enxofre, FhuF ajuda na mobilização do ferro de hidroxamato sideróforos pela atividade redutase (136) e iii) a flavina redutase geral em procariotas, reduz FMN, FAD e riboflavina utilizando NADH e NADPH e logo as flavinas redutase reduzidas, conduz na Redução dos complexos ferro-sideróforo da seguinte maneira: Fe (III) - sideróforos + NADP (H) Fe (II) - sideróforo + NAD (P)+ . O Fe solúvel (II) pode ser eliminado facilmente dos sideróforos e se utiliza diretamente em processos metabólicos e fisiológicos. Todos estes mecanismos implicam uma modificação química dos sideróforos. No entanto, recente achados demostram que o P. aeriginosa o ferro é liberdado do complexo férrico-pyoverdine simplesmente pela redução e a pyiverdine se libera reciclado em meio externo sem nenhuma modificação química (107, 138).
Regulação do Ferro nas bactérias
A regulação do ferro em bactérias gram-negativas e levada a cabo pelo regulador de absorção de ferro férrico (Fur) de protéinas (64, 65, 139, 140). Fur proteínas como se encontra também em muitas bactérias gram-positivas como B. subtilis (62). A proteína E. coli fur tem um peso molecular de 17 KDa e atua como um repressor transcricional. Regula negativamente a transcrição de genes de transporte de ferro mediante da união da região de união da pele presente água acima do gene de transporte de ferro conhecido como Fur box e se compõe de uma sequencia de repetição invertida de 19 pb. É ativado pelo ferro divalente (co-repressor) e logo reprime os gene de transporte de ferro de Downstream. A pele se une a condições deficientes de ferro, o metal se dissocia da proteína e os genes se expressão (51, 65). Em E. coli a proteína Fur controla em torno de 90 genes em nível transcricional (141). No mais, a proteína Fur ajuda na regulação de vários fatores determinantes de virulência em patógenos (139, 142). Para P. aeruginosa, a proteína Fur controla a expressão do fato sigma PvdS, que por sua vez regula a expressão da exotoxina A (93).
Significado ambiental dos sideróforos
Virulência
Diversos estudos (15, 81, 102 143-149) tem demostrado o papel dos sideróforos na mediação de patógenos (S. aureus, Listeria monocytogenes, Y. pestis, E. coli, K. pneumoniae, S. enterica, P. aeruginosa, B. subtilis) multiplicação e desenvolvimento de virulência. Em hospedeiros de mamíferos, o ferro extracelular está unido as proteínas da família da transferrina que são vitais na subministração do ferro as célula em todo o corpo. Esta estratégia, por sua vez, reduz a disponibilidade de ferro as bactérias patógenas, formando assim um componente importante da imunidade inata. Os sideróforos, devido a sua alta afinidade pelo ferro, competem com o hospedeiro de ferro vinculando proteínas de Fe3+ que é crítico para a sobrevivência de bactérias patógenas (8, 149). Por exemplo, a piridina em P. aeruginosa patógena pode sequestrar o ferro da lactoferrina do hospedeiro e a transferrina (150, 151). S. aureus utilizar seus sideróforos estafiloferrina A e estafiloferrina B para eliminar ferro da transferrina do sangue, para aumentar sua proliferação no hospedeiro (102). Junto com os sideróforos, o sistema de sinalização transmembrana implicado na captação do complexo de ironsideróforos é crucial para o desenvolvimento de fatores de virulência em bactérias como E. coli, B. cereus (152), P. aeruginosa (94, 153) e S. aureus (127). O sideróforo pyoverdine em P. aeruginosa além da extração do ferro do ambiente de benéfico se sabe que regula a produção de outros fatores de virulência como a exotoxina A e Prpl (94). Sideróforos também jogam um papel importante na formação de biofilms (154, 155). Por exemplo, nos pacientes com fibrose cística, a pioverdina é um dos fatores chave no desenvolvimento da biofilme (156).
Fitorremediação
Se tem utilizado bactérias produtoras de sideróforos para ajudar na fitoextração de metais pesados de ambientes contaminados. Os sideróforos produzidos pelas bactérias associadas com a rizosfera das plantas são de especial importância porque unem os íons de metais pesados e os pões disponíveis as raízes, melhorando assim a capacidade de fitoextração das plantas (157, 158). No mais, os sideróforos também proporcionam as plantas nutrientes (como o ferro), o que por sua vez contrapõe os efeitos nocivos do lento crescimento no metabolismo induzidos pelos metais pesados sobre a plantas (159). Por exemplo, os hidroxamatos sideróforos desferrioxamina B (DFOB), desferrioxamina E (DFOE) e coelichelin (Cch) produzidos por Streptomyces acidiscabies E13 e Straptomyces tendae F4 associados com o caupí (feijão-de-corda) (160) e o girassol (161), respectivamente, plantas em presença de Al, Cu, Mn, Ni, U (160) e Cd (161).
Os sideróforos reduzem a formação de radicais por união metálica na cercania das raízes, que por sua vez previne a degradação das auxinas microbianas, permitindo que as auxina potencialmente (162) ao fazer, desempenham sua função natural de promover o crescimento (160). Plantas de milho quando se inocula com P. aeruginosa, P. fluorescens e Ralstonia metallidurans que Pyoverdine produzido, pyochelin e alcaligelin E sideróforos, respectivamente, mostraram uma maior captação de Pb e Cr (163). Estes e vários outros estudos (157-164) tem destacado o potencial de inoculação de bactérias produtoras de sideróforos em plantas para sua capacidade de fitoextração em solos contaminados.
Fitopatologia
Há certas cepas de pseudomonas fluorescentes, conhecida como bactérias promotoras de crescimento vegetal (PGPB) que pode aumentar o crescimento de plantas e induzir a supressão de patógenos das plantas, quando inoculadas em sementes e outra partes subterrâneas (165-167). Um dos mecanismos subjacentes da supressão da enfermidade por PGRB é a produção de sideróforos como o Piochelin (165). Os sideróforos capturam o Fe ao redor (no local) das raízes e limita assim a quantidade de ferro requerida para o crescimento de patógenos como Fusarium oxusporum, Pythium ultimum e outros que causam murchamento e a enfermidade da prodridão das raízes nos cultivos (165, 168, 169). Alguns exemplos de sideróforos produtores de pseudomonas que tem sido proposto como agentes de biocontrole contra agentes de enfermidade do solo que inclui o P. fluorescente CHA0 (167), P. putida WCS (168), P. syringae pv. cepa da syringae 22d/93 (170). Estudos recentes tem demostrado que as inoculações de cepas de Pseudomonas como Bradyrhizobium e cepas de Ralstonia solani promovem o crescimento de leguminas e é completamente suprimida a enfermidade da podridão das raízes em condições experimentais (169).
Outros Metais
Os sideróforos produzidos por bactérias para a captação de ferro são também conhecidos para quelar outros metais a parte do ferro. Por exemplo, as desferroxaminas podem quelar níquel, cádmio, gálio, alumínio, vanádio e plutônio (162, 171 - 173), enquanto que a coelichelina pode quelar níquel e cádmio (162). Pyoverdine e pyochelin se informam para unir Ag+, Al3+, Cd2+, Co2+, Cr2+, Cu2+, Eu3+, Ga3+, Hg2+, Mn2+, Ni2+, Pb2+, Sn2+, Tb3+, Tl+ e Zn2+ (162, 174, 175). Os estudos tem demostrado que os metais, distintos do ferro também regulam a produção de sideróforos, dependente sobre a concentração de metais no crescimento médio (138, 176). Por exemplo, a produção de pyoverdine regulam-se sobre presença do Al3+, Cu2+, Cr2+, Ga3+, Mn2+ e Ni2+ em P. aeruginosa (175), azotochelin biossínteses foi estimulada por molibdênio em Azotobacter vinelandii (177), schizokinen e N-deoxyschizokinen a produção foi ativada em presença de concentrações de alumínio em B. megaterium (178). Desferrioxaminas B e E e Cch foram estimuladas por Cd e Ni incluso em presença de ferro férrico (162). Em P. aeruginosa, os complexos de piroddina-metal e unem ao receptor FpvA na superfície celular, inibindo assim a absorção de pioverdina-Fe3+ complexo. Encadeamento da Piruvino-metal com o receptor FpvA presumivelmente para ativar o sistema de sinalização FpvR/PvdS, que finalmente conduz a estimulação e produção da pioverdina (73, 90). Este sistema não requer a captação dos metais no citoplasma (138). Mas no caso da biossínteses de pyochelin, a piochelin-Fe depois da transferência através das células internas e externas da membranas interatuam com os reguladores AraC no citoplasma, o que requer a absorção de metal sideróforo complexo dentro do citoplasma (179). Dado que este mecanismo pode se perigoso para a célula, se os metais é tóxico, portanto, nenhum metal que não seja ativado na biossíntese do pyochelin. Metais como Fe3+, Cd2+, Cu2+, Eu3+, Ga3+, Mn2+, Ni2+ e Tb3+ quando adicionado ao ambiente de crescimento se sabe que reduzem a produção de pyochelin (176). Tal mecanismo passa-se a ter implicações na proteção das bactérias contra tóxicos no meio ambiente. Os sideróforos, por metais pesados fora da célula podem prevenir sua entrada dentro da célula por difusão através de Porins. Portanto, a capacidade de outros metais (tóxicos) que o Fe induz para a produção de sideróforos, desempenha papel importante na tolerância de metais pesados/tóxicos bacterianos (138, 179).
Biofilme
Um biofilme microbiano é uma comunidade complexa de microorganismos que crescem em uma superfície biótica ou abiótica em ambiente aquoso (180, 181). Pode ser composto de múltiplas espécies de organismos, incluindo bactérias gram-negativas junto com leveduras e protozoários (182). O desenvolvimento de um biofilme depende da disponibilidade de nutrientes e da superfície para a fixação (183, 184). O desenvolvimento de biofilme compreende quatro etapas seguintes: fixação de células planctônicas a cara, formação de microcolônias, maturação de microcolônias e finalmente o desprendimento do biofilme com estrutura madura. Microorganismos que constituem o biofilme possui comunidades extremamente complexas e fisiologia heterogênea e são muitos diferentes de seu padrões planctônicos; em contra partida são menos suscetíveis aos agentes antimicrobianos e portanto são difíceis de controlar (185, 186). Estudos tem demostrado que a concentração intracelular do ferro é uma peça importante no papel da formação do biofilme e desenvolvimento. Singh et al. (151) encontraram que a lactoferrina, o quelante do ferro no sangue de mamífero, maturação do biofilme de P. aeruginosa devido a um espasmo de motilidade exposta pela célula de P. aeruginosa em centralização que impede a formação de microcolônias para fixação a uma superfície de vidro. P. aeruginosa podem formar os biofilmes em forma de setas normais utilizando pyoverdine, pyochelin, citrato férrico ou ferrioxamina sideróforos (156). Bannin et al. (156) demonstra que os mutante de P. aeruginosa incapazes de biossíntese de pioverdine e piocheline, formou biofilme delgados em ausência de ferro. Assim, diferentes sistemas de absorção de ferro, dependendo dos diferentes ambientes pode ser crucial para o desenvolvimento de biofilmes maduros em P. aeruginosa Fur, parece regular o desenvolvimento de Biofilmes mediando a sinalização do ferro controlando o sistema de absorção de ferro e seus genes reguladores (156). Em M. smegmatis, a biossínte de exochelin é sistema essencial para o desenvolvimento de biofilmes, embora não para o crescimento planctônico (187).
Aplicações envolvendo sideróforos
Médica
Sideróforos mediado pela administração de fármacos (drogas): com o aumento da tendência de resistência aos antibióticos, tem convertido em um desenvolvimento de novas drogas e sistemas de fornecimento de tems. Desde que a captação de ferro é essencial para os patógenos, o sistema de aquisição de Fe-siderophore, as células tem explorado para fornecer drogas dentro da célula, um conceito que tem sido adotado de forma natural os compostos chamados sideromycins (danomyCins, albomycins, microsins). As sideromicinas são conjugadas portadoras de sideróforos como mediadoras para entrar nas células através do mecanismo de absorção de ferro. Esta estratégia é conhecida como "estratégia do Cavalo de Tróia" (38, 188, 189). Sintéticos análogos de sideróforos se utilizam para projetar conjugado sideróforo-antibióticos e estudos demostrado que a penetração de antibióticos (B-lactum e Sulfonamidas) através da membrana externa bacteriana, barreira através do sistema de captação de ferro mediado por sideróforo. Aumentado, quando se combina com sideróforos (189 - 192). Miller et al. (193) informou que a luta contra a malária, agente artemisinina, quando se conjuga com micobactina analítica, mostra atividade antimicrobiana em M. tuberculosis. Em 2004, alguns catecolato siderophore e B-lactum conjugados tem sido patenteados para seu uso em terapia (194). O uso de quelantes sintéticos para competir com sideróforos, o metal catiônico de gálio mostrou resultados contra as células planctônicas e biofilmes de P. aeruginosa por diminuição da captação de ferro pelo patógeno, o bloqueio de células receptoras de superfície para sideróforos (195) e aumentando a atividade antibiótica quando se conjuga com desferrioxamine (DFO) (156). A lactoferrina (151) e outros quelantes de ferro tais como Conalbumin (196, 197), férrico picolinato, acetohidroxamato férrico (198), 2,2 '- dipiridilo (2DP), ácido dietilentriaminpentacético (DTPA), EDTA, mesilato de deferoxamina (DM) e etilendiamina-N, N' - diacético (EDDA) (199) que competem com sideróforos nos orifícios para unir Fe3+, e se tem demostrado reduzir crescimento e formação de biofilme por P. aeruginosa. Recentemente, Moreau-Marquis et al. (200) demostraram que desferroxamina e desferasirox tiveram exito em agosto. A capacidade da tobramicina antibiótica para reduzir Biopelículas bacterianas causadas por antibiótico resistente a P. aeruginosa em células de fibroses quística.
Inibição das vias de biossínteses de sideróforos: outra forma de controlar a multiplicação de patógenos é a utilização de compostos químicos que bloqueiam sideróforos mediante a inibição das enzimas envolvidas no processo. A maioria dos estudos, os NRPS que estão implicados na sínteses de todos os aril cobertos e requer salicilato (SAL) o DBH (2,3 - dihidroxibenzoato) como seus substratos iniciais.
O domínio de ácido arílico A de NPRS cataliza a etapa de formação de sideróforos mediante a ativação do (SAL o DHB) via adenilação. Portanto, se tem projetado alguns inibidores que inibem a atividade catalítica do domínio de ácido arílico A, evitando o crescimento de patógenos em condições de ferro limitado (10). Exemplos de tais inibidores incluem p-aminosalisilato (PAS) em M. smegmatis e M. bovis (201), aril-ácido A domínio análogo SAL-AMS (salicil sulfamoil adenosina). Em M. tuberculosis e Y. pestis (202). Recentemente, uma nova técnica de deslocamento de polarização de fluorescência, tem sido utilizadas para criar novos inibidores de ácido aril adenilando enzimas que estavam implicadas na biossínteses de siderophore (203). Outro enfoque consiste em grupos de genes implicados na biossíntese de sideróforos que tem sugerido em M. tubercuolsis (104) e S. aureus (127)
Tipagem Bacteriana
Nas pseudomonas fluorescentes, sideróforo (pyoverdine) pode utilizar-se como um marcador taxonômico para diferenciar entre cepas extremamente relacionadas (204-206). Técnicas tais como espectrometria de massas (207) e isoeletroforesis (2) se tem utilizado como métodos eficazes de tipagem de sideróforos (208). No mais, a investigação e o desenvolvimento estão garantindo desenvolver uma base de dados e uma plataforma dedicadas a utilizar esta técnica.
Siderófosos e 'incultiváveis'
As técnicas tradicionais de cultivo mediante técnicas bacteriológica do meio de comunicação subestimam a distribuição abundante de população bacteriana total de diferetens amostras ambientais (209). Dados moleculares baseados em 16SrRNA gen estudo revelou que 99% da bacteria não cultivadas de qualquer meio ambiente em tempo dado. Recentement, um interessante estudo realizado por D'onofrio et al. (210) informaram que os sideróforos produzem as bacterias cultivadas desempenhando um papel importante no crescimento de bacterias incultas em meio sintéticos (Figura 3). Portanto, várias bacterias incultas poderiam ser recuperadas em meios sintéticos modificados com sideróforos, o qie pode conduzir ao descobrimento de microorganismos.
Conclusão
Os sideróforos são moléculas pequenas com grande potencial lógico. Com o advento de novos métodos e tecnologias de investigação e desenvolvimento que necessita se para aproveitar o aspecto benéfico destas moléculas no campo tanto da medicina como da microbiologia ambiental.
Pesquisar também:
- Biocontrol Mechanisms of siderophores against Bacterial Plant Pathogens
- SIDERÓFOROS: "UMA RESPOSTA DOS MICROORGANISMOS"
E aí, vamos elaborar Biofertilizantes (BIOPLASMA) na roça, na cidade (hortas comunitárias) nas comunidades rurais, nas universidades..?
'O resgate da memória e conhecimento sedimentam a identidade cultural, única forma de poder para dar autossustentabilidade à agriCultura'.
abraços
Feliz Natal
Oliver Blanco










3 comentários:
Belíssima página.
Muito interessante.
onde estão as referencias?
Postar um comentário
"no artigo 5º, inciso IV da Carta da República: 'é livre a manifestação do pensamento, sendo vedado o anonimato'."